摘自:《Cosmetics & Toiletries》,July/August 2022
作者 :Iva Dolecková, Ph.D., Ilona Matejková and Alina Pilipenco, Contipro a.s., Dolní Dobrouc, Czech Republic
编译 :罗骞,刘智

人体皮肤为丰富多样的微生物提供了生存空间。这些皮肤微生物群,包括:细菌、古细菌、真菌、病毒和螨虫,其构成了皮肤微生态。它们大多无害,与人体共生,并有益于我们的皮肤健康1。例如:它们能够保护皮肤免受病原体的侵害,产生各种抗菌肽,并影响宿主的先天性免疫和适应性免疫。微生物的脂肪酶能够水解皮脂中的甘油三酯2,释放甘油,滋润皮肤3;而微生物所产生的游离脂肪酸能够维持皮肤表面的微酸性保护膜,其对皮肤屏障的形成具有重要的作用。同时,在适当的皮肤水合作用下,游离脂肪酸还能促进皮肤角质的剥离4。
细菌是人体皮肤微生物群中最常见的成员。其中,痤疮表皮杆菌(Cutibacterium acnes,以前称为丙酸杆菌,Propionibacterium)和表皮葡萄球菌(Staphylococcus epidermidis)是最为丰富的物种1。皮肤微生物群的平衡对人体皮肤健康极为重要。其不平衡通常与多种皮肤疾病相关,如痤疮、银屑病、特应性和脂溢性皮炎等1。
人体皮肤微生物群的组成由多种因素决定,如身体部位、性别、年龄、饮食、卫生习惯、环境和生活方式。此项研究重点关注皮肤清洁,其是人体皮肤微生物群每日最常接受的挑战。此外,在近期新冠病毒大流行的背景下,使用更强力的清洁剂和消毒剂进行更频繁和彻底的皮肤清洁已成为当下的全球标准。虽然,这些简单的日常活动可以挽救生命,但这也对皮肤构成了重大的威胁,其减少了有益皮肤微生物菌群的数量,并对皮肤的微生态平衡造成了不利的影响。出于这些原因,保护皮肤微生态的化妆品活性成分正被推向最前沿。
皮肤微生态涉及多个方面,包括:益生菌、益生元、合生元和后生元(见表1)。此项研究的对象为益生元。历史上,大多数对益生元的研究主要集中在胃肠道部位。胃肠道益生元通常为不易消化的纤维,其为一类碳水化合物,如低聚半乳糖,低聚果糖,菊糖9。而可用于人体皮肤的益生元不需要接受胃肠道恶劣环境的考验,因此,它们可具有较低的抗性和更广泛的选择范围。
表1 益生菌、益生元、合生元和后生元的定义

许多已用作保湿和/或抗衰老功效化妆品活性成分的多糖可为皮肤微生态提供营养,因此,可作为皮肤益生元。
此项研究采用体外细胞培养(in-vitro)和志愿者清洁皮肤(in-vitro)评估多种化妆品多糖成分对不同种类细菌生长状况的影响,包含不同分子量(MW)的透明质酸(hyaluronic acid,HA),如1.6MDa,300kDa,16kDa和3.6kDa;羧甲基β-葡聚糖钠(CM- glucan);葡甘露聚糖(glucomannan);裂裥菌素(schizophyllan)等。
材料和方法
测试物:此项研究所使用的化妆品多糖如表2所示:
表2 测试用化妆品多糖

所有原料由Contipro A.S.提供
体外实验:痤疮表皮杆菌(C.acnes,strain DSM 1897)和表皮葡萄球菌(S. epidermidis,strain CCM 2124, DSZM collection)在含有0.1%测试物的胰蛋白胨大豆肉汤(TSB, Merck)中37℃培养6小时(痤疮表皮杆菌,C.acnes)和72小时(表皮葡萄球菌,S. epidermidis)。在培养期间测试样品的光密度值OD600,在细胞培养的指数生长期样品的测试值用作评估;2小时(痤疮表皮杆菌,C.acnes)和40小时(表皮葡萄球菌,S. epidermidis)。
体内实验:体内实验研究符合赫尔辛基世界医学大会宣言,并得到了内部伦理委员会的批准和所有志愿者的知情同意。仅健康、没有皮肤病的受试者参与了此项研究。其他排除标准,包括怀孕,哺乳期,以及在此项研究前近6个月内全身或局部使用抗生素或抗真菌药物等。测试期间,不允许清洗面部或涂抹化妆品。
在10名25 - 40岁女性受试者的额头两侧用浸有1mL 10%椰油酰胺丙基甜菜碱(CAPB,Sabo)的方形纱布擦拭5次。15分钟后,在洁净的皮肤上涂抹0.1g测试样品(见配方1),驻留2小时。分别于实验开始时,使用CAPB清洁皮肤15分钟后以及涂抹测试样品后2小时采集样本。获取皮肤微生物群样本,用无菌棉签轻轻擦拭皮肤,随后将棉签在含0.15M NaCl,0.1%聚山梨酯20的溶液中浸泡30秒。
配方1 测试乳液的成分

在获取皮肤微生物群样本的同时,测试受试者皮肤的皮脂含量(SM 815 Sebumeter),经皮水分散失值(TEWL,TM 300 Tewameter)和皮肤pH值(PH 905 skin pH meter)。相同的受试者使用不同的测试样品重复上述实验,2次实验至少间隔2天。
qPCR分析细菌的种类:使用广泛适用于细菌(16S rDNA 保守区10)且特异于表皮葡萄球菌(S. epidermidis,femA 基因11)和痤疮表皮杆菌(C.acnes,16S rDNA 特异性保守区12)的引物和探针(Elisabeth Pharmacon),通过实时定量PCR对皮肤微生物样本进行分析。
统计分析:采用Student’s t-test对实验结果的统计显著性进行评估;当p值< 0.05时,结果被认为差异显著(* p < 0.05, **p < 0.01, ***p < 0.001)。
体外实验测试结果
采用微生物培养的体外测试研究表明,测试物在一定程度刺激了表皮葡萄球菌(S. epidermidis)的生长,其中,VLMW HA(16 kDA)和CM-glucan效果显著。由于裂褶多糖与培养基不相溶,因此,实验未对其进行评估(见图1A)。
相较之下,除了HMW HA能够显著抑制痤疮表皮杆菌(C.acnes)的生长外,其他测事物对其生长没有显著影响(见图1B)。
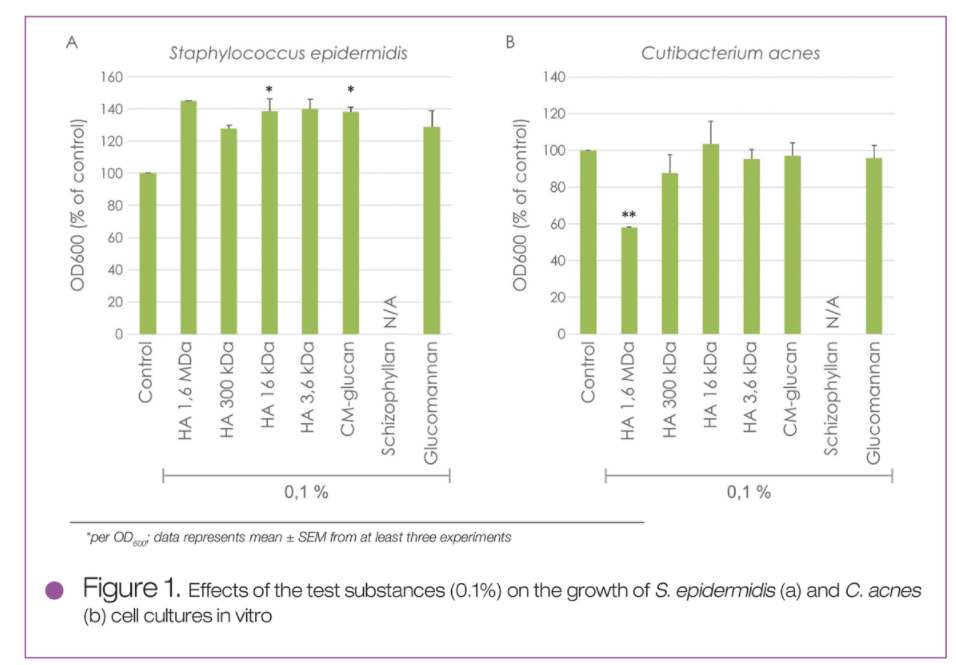
图1 细胞培养体外实验测试0.1%测试物对表皮葡萄球菌(S. epidermidis)和痤疮表皮杆菌(C.acnes)生长的影响
体内实验测试结果
对受试者的体内测试研究表明,使用CAPB清洁皮肤可去除皮肤表面大量皮脂(见图2A),显著增加TEWL值(见图2B),但不影响皮肤pH值(见图2C)。在清洁皮肤后,细菌总数大量减少(图3a),洁净皮肤上残留的两种主要细菌的数量平衡被扰乱:表皮葡萄球菌(S. epidermidis)的数量显著降低(见图3B)而痤疮表皮杆菌(C.acnes)的数量则少量升高(见图3C) - 两者均与清洁皮肤后细菌总数的减少相关;因此,痤疮表皮杆菌(C.acnes)的绝对数量依然较低。
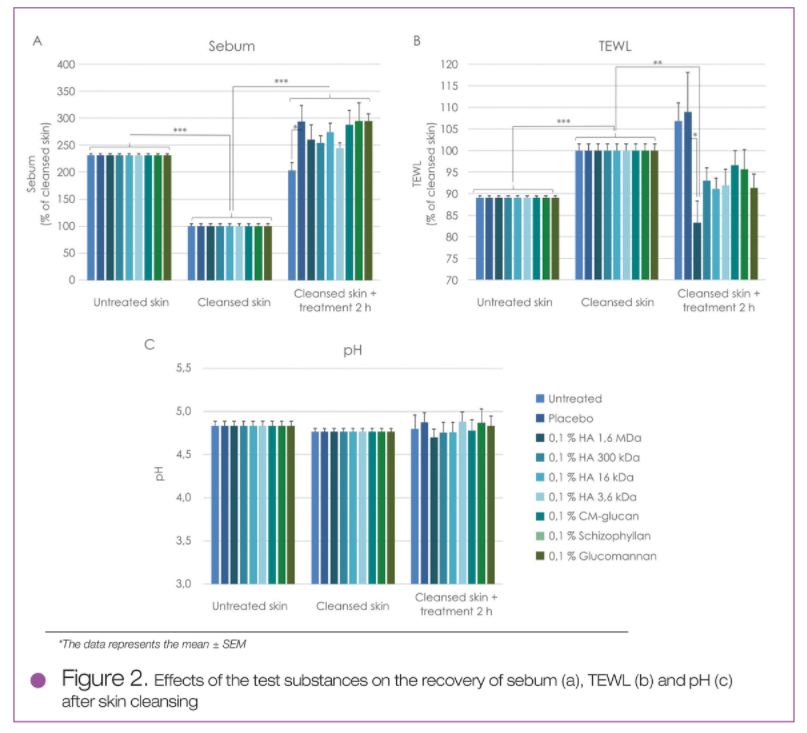
图2 清洁皮肤后测试物对皮肤皮脂(A),TEWL值(B)和pH值(C)的影响
皮肤清洁2小时后,皮肤的皮脂水平接近正常,而皮肤的TEWL值,细菌总数,表皮葡萄球菌(S. epidermidis)和痤疮表皮杆菌(C.acnes)的数量没有显著性改变。与未经处理的洁净皮肤相比,包括对照组在内的所有测试样品均能如预期增加皮肤皮脂的测试值,这可能是由于样品配方中含有油脂成分所致(图2A)。
与未经处理的洁净皮肤或对照组相比,所有含多糖成分的测试样品均能降低皮肤的TEWL值(见图2B),并在清洁皮肤后增加皮肤的细菌总数(见图3A)。针对上述2个实验的结果,HMW HA效果最为明显,这可能与原料自身的封闭和成膜作用以及微生物对其的利用程度有关。
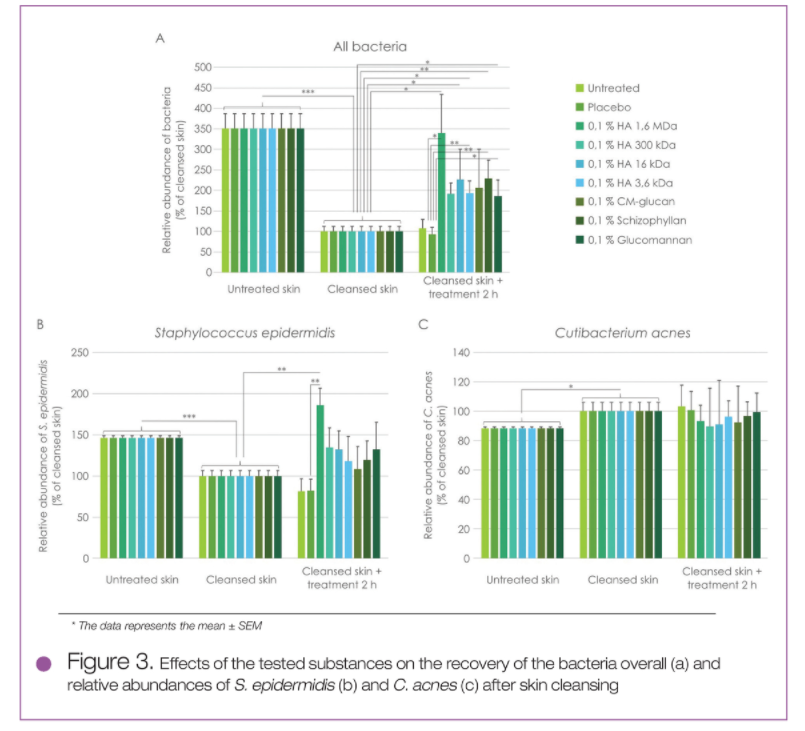
图3 清洁皮肤后测试物对皮肤菌落总数(A),表皮葡萄球菌(S. epidermidis)(B)和痤疮表皮杆菌(C.acnes)数量(C)的影响
针对皮肤中这两种主要细菌的数量恢复至正常的水平,多糖能够发挥一定的作用。其能够增加表皮葡萄球菌(S. epidermidis)的数量,少量降低痤疮表皮杆菌(C.acnes)的数量,然而其对两种细菌生长的影响效果不显著(见图3C)。
讨论:皮肤清洁
皮肤清洁已成为一种日常的生活习惯,它能够通过化学或机械的方式去除皮肤表面的污垢、化妆品、汗液、皮脂、死皮细胞和潜在病原体。尽管其对人类健康和预防传染病具有毋庸置疑的作用,但它对正常的皮肤共生菌群也有不利的影响13。皮肤微生态的失衡与表皮中蛋白和脂质被去除和/或损坏共同作用,可导致皮肤屏障被破坏、干燥、刺激、瘙痒以及各种皮肤疾病的持续或恶化14。
市场上有许多不同类型的皮肤清洁产品,包括传统的产品在内,其通常使用碱性较高的皂基或合成清洁剂成分,如十二烷基硫酸钠。这些表面后活性剂通常具有较强的清洁力,但可导致严重的皮肤损伤和刺激15。而CAPB是一种温和的表面活性剂,其来源于椰子油,可用于儿童化妆品15。
然而,此项实验结果表明,尽管CAPB这种温和的清洁剂不会影响皮肤pH值,且能够显著去除皮肤的油脂,但其也造成了与皮肤屏障损伤相关的TEWL值的增加,并减少了皮肤常见细菌共生体的数量。事实上,单独用水清洗皮肤也会引起各种变化(如皮脂的减少和表皮葡萄球菌(S. epidermidis)数量的降低),但程度要小的多(数据未提供)。皮肤清洁为微生物创造了一个自由的生活空间,但也增加了皮肤受病原体侵害,或造成皮肤常见微生物过度生长的风险。
此外,实验结果也表明,清洁皮肤后在皮肤残留的两种主要微生物的比例也发生了一定的变化:表皮葡萄球菌(S. epidermidis)的数量急剧下降,而痤疮表皮杆菌(C.acnes)的数量有所增加。这可能是因为亲油的痤疮表皮杆菌(C.acnes)更倾向于在皮脂腺部位生长,如毛囊,从而防止了通过简单的擦拭造成其有效去除。因此,其在皮肤表面的残留量高于表皮葡萄球菌(S. epidermidis)。痤疮表皮杆菌(C.acnes)对寻常性痤疮的作用已得到充分的证明16,在皮肤清洁后其相对比例的增加会对易患痤疮的皮肤构成潜在威胁,并可能导致问题的恶化。
为了保持皮肤正常的功能和外观,在皮肤清洁后尽快恢复皮肤的微生态平衡显得至关重要。因此,如前所述,此项研究评估了几种常见的化妆品多糖成分作为潜在的皮肤益生元,以实现这一目标。
透明质酸( Hyaluronic Acid,HA)
HA是一种糖胺聚糖(或称粘多糖,glycosaminoglycan),其在人体内具有填补空间和润滑剂的作用,并参与各种生理过程17。其应用广泛,是最受欢迎的化妆品保湿和抗衰老活性成分之一18。HA的活性取决于其自身的分子量(MW)。高分子量透明质酸(HMW HA)通常能够驻留在皮肤表面,有效滋润皮肤,而低分子量透明质酸(LMW HA)则能够深入皮肤,作用于皮肤的活细胞,提供更好的抗衰老效果19。
实际上,HA并不是一种典型的益生元,尽管一些体外实验表明其能够促进某些乳酸杆菌菌株(Lactobacillus strains)的生长20,此项研究也证明了其对表皮葡萄球菌(S. epidermidis)生长的促进作用21。此外,HMW HA能够抑制痤疮表皮杆菌(C.acnes)的生长,但作用机理尚不明确。
体内实验结果表明,HMW HA在皮肤清洁后对皮肤细菌总数的快速恢复以及两种主要细菌间比率的正常化,影响最为显著。HMW和LMW HA的功效差异可能是由其不同的皮肤渗透性所致。HMW HA具有较强的成膜作用,其能够驻留在皮肤表面,使皮肤TEWL值显著降低,可能更适合于皮肤微生物群。相反,低分子量HA能够较好的渗透至皮肤19,但为皮肤表面的微生物提供了更少的营养物质。体内实验所观察到的HMW HA对痤疮表皮杆菌(C.acnes)的选择性抑制作用可能加速了表皮葡萄球菌(S. epidermidis)数量的快速恢复,从而使两种主要细菌间比率的更快趋于正常。
羧甲基β-葡聚糖钠(CM- glucan),葡甘露聚糖(glucomannan)和裂裥菌素(schizophyllan)
此项研究还评估了其他几种常见的化妆品多糖:来源于啤酒酵母菌(Saccharomyces cerevisiae)的β-葡聚糖经羧甲基化制备的羧甲基β-葡聚糖钠;另一种来源于裂褶菌(Schizophpyllum commune)的β-葡聚糖22,裂裥菌素;来源于产朊假丝酵母(Candida utilis)的一种高度支链化α-甘露聚糖,其支链联有葡萄糖残基23。
β-葡聚糖是一种多糖物质,其广泛存在于植物、真菌和某些细菌中。它们常作为胃肠道益生元添加到膳食补充剂中,具有多种生物活性,包括降低血液胆固醇水平和血糖指数(glycemic index,GI),以及防止感染24。这些作用通常归因于其众所周知的免疫调节和抗氧化特性。β-葡聚糖也可用作具有保湿和抗衰老功效的局部用皮肤制剂24。
有关酵母葡甘露聚糖的研究较少。目前,仅有少数研究表明其具有免疫调节、抗氧化和抗突变特性25-27。一种类似的物质,魔芋葡甘聚糖水解物,已被用作胃肠道益生元28。在阴道制剂中,其有助于经抗真菌药物治疗后健康阴道微生物群的恢复29。此外,体内研究还表明,其能够抑制痤疮表皮杆菌(C.acnes)的生长30。
此项实验结果表明,上述三种多糖在清洁皮肤后均能使皮肤细菌的数量快速恢复至正常,同时,也能使表皮葡萄球菌(S. epidermidis)和痤疮表皮杆菌(C.acnes)的相对数量得到了一定的增加,但其对痤疮表皮杆菌(C.acnes)数量增加的程度较小。三种多糖的功效与低分子量HA相似,但低于HMW HA。同样,其原因可能是由于三种多糖的低分子量和高皮肤渗透性影响了其在皮肤表面的生物利用度。
结论
综上所述,此项研究通过相关测试证明了HA和其他几种常见的化妆品用多糖成分可作为有效的皮肤益生元,其能够在皮肤环境受到干扰后使正常皮肤的微生态恢复平衡。HMW HA被证明最为有效,皮肤表面的微生物群对其较高的生物利用度可能与其自身较高的分子量有关。
原文链接:
参考文献
1. Byrd, A.L., Belkaid, Y. and Segre, J.A. (2018). The human skin microbiome. Nat Rev Microbiol 16 143–155.
2. Ingham, E., Holland, K.T., Gowland, G. and Cunliffe, W.J. (1981). Partial purification and characterization of lipase (EC 3.1.1.3) from Propionibacterium acnes. J Gen Microbiol 124 393–401.
3. Fluhr, J.W., Mao-Qiang, M., Brown, B.E., Wertz, P.W., Crumrine, D., Sundberg, J.P., Feingold, K.R., and Elias, P.M. (2003). Glycerol regulates stratum corneum hydration in sebaceous gland deficient (asebia) mice. J Invest Dermatol 120 728–737.
4. Harrison-Tryon, et al. (2022, May 27). Microbiota and maintenance of skin barrier function. Science 376 940-945.
5. Hill, C., Guarner, F., ... Salminen, S., et al. (2014). Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 11 506–514.
6. Gibson, G.R., Hutkins, R., ... Cani, P.D., et al. (2017). Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol 14 491–502.
7. Vallianou, N., Stratigou, T., Christodoulatos, G.S., Tsigalou, C. and Dalamaga, M. (2020). Probiotics, prebiotics, synbiotics, postbiotics and obesity: Current evidence, controversies and perspectives. Curr Obes Rep 9 179–192.
8. Collado, M.C., Vinderola, G. and Salminen, S. (2019). Postbiotics: Facts and open questions. A position paper on the need for a consensus definition. Benef Microbes 10 711–719.
9. Davani-Davari, D., Negahdaripour, M., ... Ghasemi, Y., et al. (2019). Prebiotics: Definition, types, sources, mechanisms and clinical applications. Foods Basel Switz 8.
10. Nadkarni, M.A., Marin, F.E., Jacques, N.A., and Hunter, N. (2002). Determination of bacterial load by real-time PCR using a broad-range (universal) probe and primers set. Microbial Read Engl 148 257-266.
11. Francois, P., Pittet, D., Bento, M., Pepey, B., Vaudaux, P., Lew, D. and Schrenzel, J. (2003). Rapid detection of mechicilin-resistant Staphylococcus aureus directly from sterile or nonsterile clinical samples by a new molecular assay. J Clin Microbiol 41-254-260.
12. Fukumoto, H., Sato, Y., Hasegawa, H., Saeki, H. and Katano, H. (2015). Development of a new real-time PCR system for simultaneous detection of bacteria and fungi in pathological samples. Int J Chin Exp Pathol 8 15479-15488.
13. Jensen, D.A., Rogers, M.A., and Schaffner, D.W. (2017). Surfactant concentration and type affects the removal of Esherichia coli from pig skin during a stimulated hand wash. Lett Appl Microbiol 65 292-297.
14. Ananthapadmanabhan, K.P., Moore, D.J., Subramanyan, K., Misra, M., and Meyer, F. (2004). Cleansing without compromise: The impact of cleansers on the skin barrier and the technology of mild cleansing. Dermatol Ther 17 Suppl 1 16-25.
15. Draelos, Z.D. (2018). The science behind skin care: Cleansers. J Cosmet Dermatol 17 8-14.
16. McLaughlin, J., Watterson, S., Layton, A.M., Bjourson, A.J., Barnard, E and McDowell, A. (2019). Propionibacterium acnes and Acne vulgaris: New insights from the integration of population genetic, multi-omic, biochemical and host-microbe studies. Microorganisms 7.
17. Korgan, G., Sandula, J. and Simkovicová, V. (1993). Glucomannan from Candida utilis. Structural investigation. Folia Microbiol (Praha) 38 219-224.
18. Kim, H., Jeong, H., … Hahn, S.K., et al. (2017). Hyaluronate and its derivatives for the customized biomedical applications. Biomaterials 123 155-171.
19. Farwick, M., Lersch, P. and Strutz, G. (2008). Low molecular weight hyaluronic acid: Its effects on epidermal gene expression and skin aging. I 11 134-137.
20. Di Cerbo, A., Aponte, M., Esposito, R., Bondi, M., and Palmieri, B. (2013). Comparison of the effects of hyaluronidase and hyaluronic acid on probiotics growth. BMC Microbiol. 13 243.
21. Gallenga, P.E., Mastropasqua, L., … Piccolomini, R., etal. (1998). In vitro Staphylococcus epidermidis growth in some viscoelastic substances containing sodium hyaluronate. Ophthalmol 212 184-187.
22. Smirncou, D., Knotek, P., Nesporoa, K., Smejkalova, D., Pavlik, V., Franke, L. and Velebny., V. (2017). Ultrasound-assisted production of highly-purified β-glucan schizophyllan and characterization of its immune properties. Process Biochem 58 313-319.
23. Kogan, G., Soltés, L., Stern, R. and Gemeiner, P. (2007). Hyaluronic acid: A natural biopolymer with a broad range of biomedical and industrial applications. Biotechnol Lett 29 17-25.
24. Vetvicka, V., Vannucci, L., Sima, P. and Richter, J. (2019). Beta glucan: Supplement or drug? From laboratory to clinical trials. Mol Basel Switz 24.
25. Bauerova, K., Ponist, S., … Mihalova, D., et al (2008). Glucomannan in prevention of oxidative stress and inflammation occurring in adjuvant arthritis. Neuro Endocrinol Lett 29 691-696.
26. Kumano, N., Suzuki, S., Ishikawa, T., Koinumaru, S. and Konno, K. (1985). Antitumor effect of the yeast polysaccharide preparation in syngeneic mouse tumor models. Tohoku J Exp Med 146 89-96.
27. Ruszova, E., Pavek, S., Hajkova, V., Jandova, S., Velebny, V., Papezikova, I. and Kubala, L. (2008). Photoprotective effects of glucomannan isolated from Candida utilis. Carbohydro Res 343 501-511.
28. AI-Ghazzewi, F.H., Khanna, S., Tester, R.F. and Piggott, J. (2007). The potential use of hydrolysed konjac glucomannan as a prebiotic. J Sci Food Agric 87 1758-1766.
29. Tester, R., AI-Ghazzewi, F., … Tang, M., et al. (2012). The use of konjac glucomannan hydrolysates to recover health microbiota in infected vaginas treated with an antifungal agent. Benef Microbes 3 61-66.
30. AI-Ghazzewi, F.H., and Tester, R. F. (2010). Effect of konjac glucomannan hydrolysates and probiotics on the growth of the skin bacterium Propionibacterium acnes in vitro. Int J Cosmet Sci 32 139-142.